- +7 777 150 51 51
Основные положения МКТ
Основные термины и необходимые понятия:
- Молекулярно кинетическая теория. (МКТ)
- Броуновское движение
- Температура
- Диффузия
- Атомная единица массы
- Число Авогадро
- Моль вещества
Основные положения МКТ
- Все вещества состоят из частиц.
- Эти частицы находятся в непрерывном хаотическом движении.
- Частицы могут и взаимодействуют друг с другом.
Броуновское движение
Броуновское движение — это хаотичное перемещение мельчайших частиц, находящихся в жидкости или газе. Такое движение возникает из-за беспорядочных столкновений этих частиц с молекулами среды, которые непрерывно движутся из-за тепловой энергии
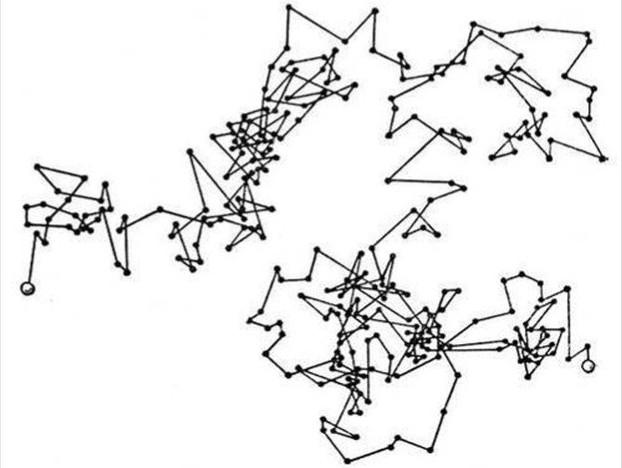
|
Эксперимент Роберта Броуна: 1. Под окуляр микроскопа помещали воду и координатную сетку. 2. В воду добавляли крупные частицы (например, споры папоротников), видимые в оптический микроскоп. 3. Фокус микроскопа наводили на одну частицу. 4. Фиксировали её положение на сетке в течение длительного времени. 5. Получалась ломаная траектория, свидетельствующая о хаотичном движении. 6. Движение объясняется случайными ударами молекул жидкости. |
Температура – физическая величина, характеризующую среднюю кинетическую энергию молекул вещества.
Диффузия — взаимное проникновение молекул одного вещества в межмолекулярные промежутки другого в результате их хаотического движения.
По международному соглашению, за 1 атомную единицу принята масса соответствующая массе атома \({}^{1}_{1}\mathrm{H}\).(сокращение: а.е.м – атомная единица массы). По современным данным 1 а. е. м. \(\approx\) \(1.66 \cdot 10^{-27}\) кг
Обратим внимание на 2 очень важных момента:
- Масса протона (\(m_p)=1.673 \cdot 10^{-27}кг\) приблизительно равна массе нейтрона(\(m_n)=1.675 \cdot 10^{-27}кг\)
- Масса протона \(1.673 \cdot 10^{-27}кг\) приблизительно в 2000 раз больше массы электрона (\(m_e)=9.1 \cdot 10^{-31}кг\), поэтому при расчете массы молекулы массой электрона можно пренебречь. Таким образом можно сказать, что атомная масса приблизительно равна массе протона или нейтрона.
Молярная масса — масса одного моля вещества, измеряется в граммах на моль (г/моль). Обозначается \(( M )\).Массы отдельных атомов (а значит также и молекул) всех веществ приблизительно кратны друг другу.
Число Авогадро — количество молекул в одном моле вещества, равно \( N_A = 6.02 \cdot 10^{23} молекул/моль\).
Количество вещества — физическая величина, определяющая число молекул в образце вещества. Измеряется в молях \(( \nu )\).
Формула:
$$
\ \nu = \frac{N}{N_A} ,$$
где \( N \) — число молекул, \( N_A = 6.02 \cdot 10^{23} молекул/моль\).
Примеры решения задач
1.Сравнить количество молекул воды в 6-ти литровой банке воды, и молекул Азота \(N_2\) в комнате объемом \(100 м^3\). (Плотность воздуха взять =\(1.3 кг/ м^3\))
|
\( Дано: \) \( V_{\text{воды}} = 6 \ \text{л} = 6 \cdot 10^{-3} \ \text{м}^3 \) \( M_{\text{воды}} = 18 \ кг/кмоль \) \( \rho_{\text{воды}} = 1000 \ \text{кг/м}^3 \) \( V_{\text{возд}} = 100 \ \text{м}^3 \) \( M_{\text{азота}} = 0{,}028 \ кг/моль\) \( \rho_{\text{возд}} = 1{,}3 \ \text{кг/м}^3 \) \( N_A = 6{,}02 \cdot 10^{23} \ молекул/моль \) \( Найти: \quad N_{\text{воды}}, \ N_{\text{возд}}, \ \frac{N_{\text{возд}}}{N_{\text{воды}}} = ? \) |
|
2.Оценить массу вещества в сосуде, если известно что в нем находится \(10^{22}\) молекул, а молярная масса равна 602 г/моль. В качестве ответа дать формулу, по которой можно оценить количество молекул, и число – количество молекул.
|
\( Дано: \) \( N = 10^{22} \ \text{молекул} \) \( M = 602 \ г/моль \) \( N_A = 6{,}02 \cdot 10^{23} \ молекул/моль \) \( Найти: \quad m = ? \) |
|
3.Оценить массу Азота в сосуде, если известно что в нем находится \(10^{23}\) молекул. В качестве ответа дать формулу, по которой можно оценить количество молекул, и число – количество молекул.
|
\( Дано: \) \( N = 10^{23} \ \text{молекул} \) \( M_{\text{азота}} = 28 \ г/моль \) \( N_A = 6{,}02 \cdot 10^{23} \ молекул/моль \) \( Найти: \quad m = ? \) |
|