- +7 701 537 76 67
Газовые законы
Идеальный газ — модель газа, обладающая следующими характеристиками:
- Состоит из отдельных молекул.
- Молекулы не взаимодействуют на расстоянии (взаимодействуют только при столкновении как упругие шарики).
Уравне́ние состоя́ния — соотношение, отражающее для конкретного класса термодинамических систем связь между макроскопическими физическими величинами: температура, давление, объем, химический потенциал, энтропия, внутренняя энергия, энтальпия и др.
Уравне́ние состоя́ния идеального газа — соотношение, отражающее связь между температурой, давлением, объемом и количеством вещества.
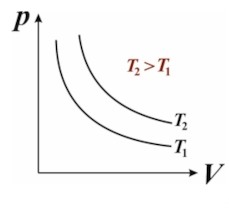
Закон Бойля–Мариотта
Для данного, не меняющегося количества идеального газа, произведение давления газа на занимаемый им объём при постоянной температуре — постоянно:
$$
P V = \text{const} \quad (T = \text{const})
$$
Закон Шарля
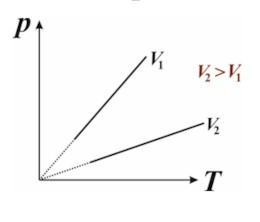
Для данного количества идеального газа, отношение давления к абсолютной температуре при постоянном объёме — постоянно:
$$
\frac{P}{T} = \text{const} \quad (V = \text{const})
$$
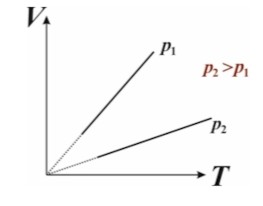
Закон Гей-Люссака
Для данного количества идеального газа, отношение объема к температуре при постоянном давлении — постоянно:
$$
\frac{V}{T} = \text{const} \quad (P = \text{const})
$$
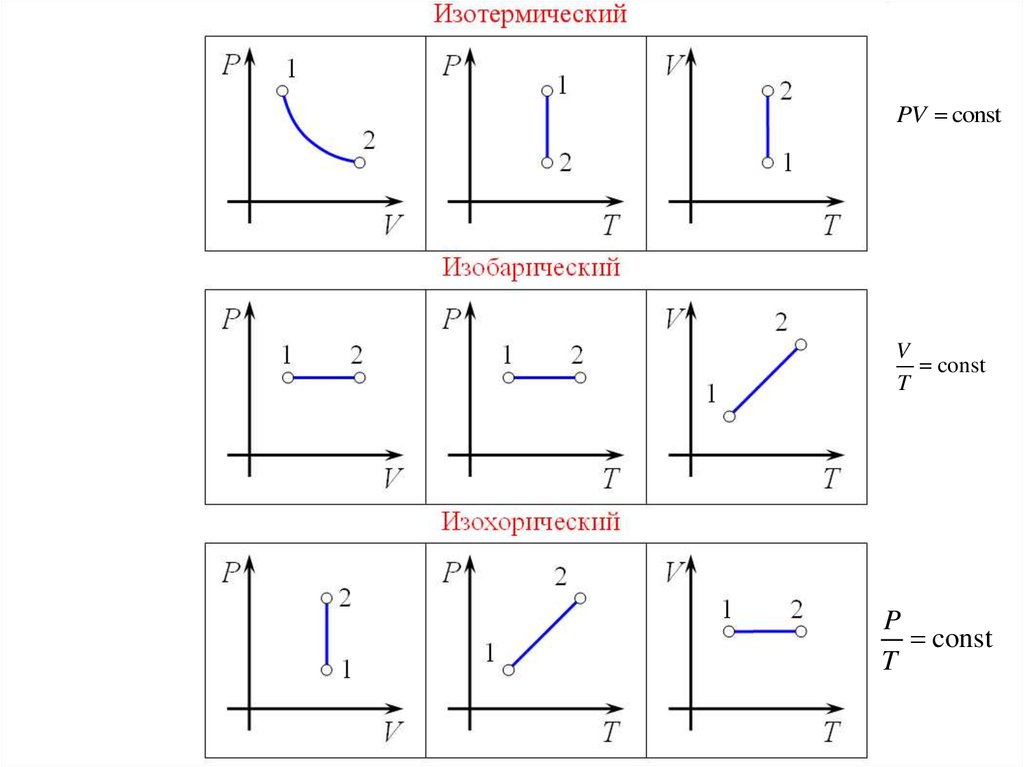
Изопроцессы — это термодинамические процессы, при которых одно из параметров состояния (P, V или T) остаётся неизменным, а также количество вещества не меняется.
Закон Клапейрона (Менделеева–Клапейрона)
Для данного количества идеального газа произведение давления на объём прямо пропорционально температуре:
$$
P V = \nu R T
$$
где:
- \( P — давление (Па)\)
- \( V — объём (м³)\)
- \( T — \text{абсолютная температура} (К)\)
- \( \nu — \text{количество вещества} (моль)\)
- \( R = 8.31 \ — \text{универсальная газовая постоянная}(Дж/моль·К)\)
Количество вещества через массу и молярную массу:
$$
\nu = \frac{m}{M}
$$
Тогда уравнение принимает вид:
$$
P V = \frac{m}{M} R T
$$
Закон Дальтона
Закон Дальтона описывает давление в газовых смесях. Он гласит, что общее давление смеси равно сумме парциальных давлений всех газов в смеси.
Парциальное давление — давление, которое оказывал бы каждый газ, если бы он один занимал весь объём смеси при той же температуре.
Формула закона Дальтона:
$$
P = P_1 + P_2 + P_3 + \dots + P_n
$$
где:
- \( P \) — общее давление смеси
- \( P_1, P_2, \dots, P_n \) — парциальные давления отдельных газов
Пример задач
1.В закрытом недеформируемом сосуде нагревают газ от температуры 20 градусов цельсия до 40 градусов цельсия. Начальное давление было равно 1 атм. Каково давление в сосуде в конце процесса. В качестве ответа дать формулу, по которой можно оценить давление, и число – давление в атм.
|
\( \text{Дано:} \)
\( T_1 = 20^\circ C = 293 \ \text{K} \) \( T_2 = 40^\circ C = 313 \ \text{K} \) \( p_1 = 1 \ \text{атм} \) \( \text{Найти: } p_2 = ? \) |
\( \text{Решение:} \)
Процесс изохорный, используем формулу: \[ \frac{p_1}{T_1} = \frac{p_2}{T_2} \Rightarrow p_2 = p_1 \cdot \frac{T_2}{T_1} \] \[ p_2 = 1 \cdot \frac{313}{293} \approx 1.0686 \ \text{атм} \] \( \textit{Ответ:} \ p_2 \approx 1.07 \ \text{атм} \) |
2. В закрытом тонкой пленкой сосуде (давление в сосуде всегда равно атмосферному) нагревают газ от температуры 0 градусов Цельсия до 40 градусов Цельсия. Начальный объем равен \( 1 \ \text{м}^3 \). Какой объем занимает газ в конце процесса? В качестве ответа дать формулу, по которой можно оценить объем, и число – объем в \( \text{м}^3 \).
|
\( \text{Дано:} \)
\( T_1 = 0^\circ C = 273 \ \text{K} \) \( T_2 = 40^\circ C = 313 \ \text{K} \) \( V_1 = 1 \ \text{м}^3 \) \( \text{Найти: } V_2 = ? \) |
\( \text{Решение:} \)
Процесс изобарный, используем формулу: \[ \frac{V_1}{T_1} = \frac{V_2}{T_2} \Rightarrow V_2 = V_1 \cdot \frac{T_2}{T_1} \] \[ V_2 = 1 \cdot \frac{313}{273} \approx 1.1465 \ \text{м}^3 \] \( \textit{Ответ:} \ V_2 \approx 1.15 \ \text{м}^3 \) |
3.В закрытом сосуде с поршнем, при постоянной температуре, проводят процесс при которов объем сосуда уменьшается в 2 раза. Если давление в начале процесса было равно 2 атм, чему равно давление в конце процесса. В качестве ответа дать формулу, по которой можно оценить давление, и число – давление в Па.
|
\( \text{Дано:} \)
\( V_2 = \frac{1}{2} V_1 \) \( T = \text{const} \) \( p_1 = 2 \ \text{атм} \) \( \text{Найти: } p_2 = ? \) |
\( \text{Решение:} \)
Процесс изотермический: \[ p_1 V_1 = p_2 V_2 \Rightarrow p_2 = p_1 \cdot \frac{V_1}{V_2} \] \[ p_2 = 2 \cdot \frac{V_1}{\frac{1}{2}V_1} = 2 \cdot 2 = 4 \ \text{атм} \] Переведём в Паскали: \[ p_2 = 4 \cdot 1.013 \cdot 10^5 = 4.052 \cdot 10^5 \ \text{Па} \] \( \textit{Ответ:} \ p_2 = 4.05 \cdot 10^5 \ \text{Па} \) |